Эпидуральная анестезия: риски для матери и ребенка
Перевод статьи Сары Бакли «The hidden risks of epidurals»
Содержание
- Эпидуральная анестезия и гормоны родов
- Влияние на родовой процесс
- Побочные эффекты эпидуральной анестезии
- Выводы
- Источники
Первое зарегистрированное использование эпидуральной анестезии было проведено в 1885 году в Нью-Йорке американским неврологом Леонардом Корнингом, вводившим кокаин в спину пациента, страдающего от «спинномозговой слабости и недержания семенной жидкости» (1).
Более века спустя эпидуральная анестезия стала самым популярным методом обезболивания в родильных центрах США (2). В 2004 г. почти две трети рожениц использовали этот способ облегчения боли, включая 59% женщин, рожавших вагинально. В Канаде эпидуральную анестезию используют около половины женщин, рожающих вагинально (3), в Великобритании – около 21% (4).
Эпидуральная анестезия – это введение местного анестетика (производное кокаина), под твердую оболочку спинного мозга (эпидуральное пространство). Традиционная эпидуральная анестезия блокирует как чувствительные, так и двигательные нервы – обеспечивая эффективное обезболивание в родах, но лишая женщину возможности двигать нижней половиной тела. В течение последних 5-10 лет была разработана так называемая «ходячая» эпидуральная анестезия – благодаря использованию более низких концентраций местных анестетиков, или комбинаций анестетика и опиатов (подобных морфину и меперидину), что позволило уменьшить блокирование двигательных нервов.
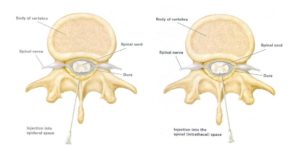
Также значительно возросла частота применения спинальной анестезии в родах для уменьшения блокирования двигательных нервов. При спинальной анестезии действующее вещество вводится через твердую мозговую оболочку прямо в спинномозговое пространство и вызывает лишь краткосрочное обезболивание (механизм действия спинальной анестезии заключается в блокаде спинного мозга, а не конечных участков нервов, как при эпидуральном обезболивании – прим. ред.). Для продления эффекта спинальную и эпидуральную анестезию применяют одновременно (CSE – combined spinal epidural).
CSE обеспечивает наиболее эффективное обезболивание родов, и женщины с CSE оценивали степень облегчения боли как очень высокую. Однако удовлетворенность от облегчения боли не следует сопоставлять с общим удовлетворением от родов (5), поскольку ЭА значительно вмешивается в процесс родов. ЭА может влиять на удовлетворенность женщины своими родами, и даже поставить под угрозу безопасность матери и младенца.
Эпидуральная анестезия и гормоны родов
Эпидуральная анестезия значительно изменяет гормональный баланс, присущий физиологическим родам, и этим может объясняться ее негативное влияние на процесс родов (6). В комментариях Всемирной Организации Здравоохранения говорится: «эпидуральная анестезия является одним из самых ярких примеров медикализации нормальных родов, превращающая физиологическое событие в медицинскую процедуру» (7).
Например, окситоцин, известный как гормон любви, является естественным утеротоником –веществом, вызывающим сокращения матки в родах. Эпидуральная анестезия понижает продукцию окситоцина в организме женщины (8) или останавливает нарастание его концентрации в течение родов (9), а спинальная анестезия имеет еще более ярко выраженный эффект (9). Кроме того, при ЭА не наблюдается пика выброса окситоцина, который происходит при рождении ребенка – высочайшей концентрации этого гормона за всю жизнь женщины (10). Этот пик вызывает мощные финальные сокращения матки и помогает матери испытать прилив любви к своему малышу при их первой встрече (12). Концентрация еще одного важного гормона-утеротоника, простагландина F2-альфа, также снижается во время применения анестезии (11).
Бета-эндорфины – гормоны стресса, которые накапливаются у роженицы, чтобы помочь ей преодолеть боль. Бета-эндорфины вызывают измененное состояние сознания, которое нормально для родов. Родовой транс помогает женщине взаимодействовать со своим телом и с малышом инстинктивно, используя различные движения и звуки. Исследования показывают, что эпидуральная анестезия снижает уровень бета-эндорфинов (12, 13). Возможно, именно широкое распространение ЭА объясняет наши сложности в адекватной поддержке женщин в таком измененном состоянии сознания, и социальные ожидания предписывают женщине быть тихой и уступчивой в родах.
Адреналин и норадреналин (или эпинефрин и норэпинефрин, известные под общим названием катехоламинов) также выделяются в стрессовых ситуациях, и их уровни возрастают в естественных родах без медицинских вмешательств (14). В конце таких родов всплеск катехоламинов обеспечивает женщину энергией для потуг, а также возвращает ее из родового транса обратно в ясное сознание для первой встречи с малышом. Это называется «рефлекс изгнания плода» (15).
Однако высокие уровни катехоламинов тормозят роды, и это проявляется, когда роженица испытывает голод, страх, холод или просто не чувствует себя в безопасности (16). С точки зрения эволюции, это имеет смысл: если мать чувствует опасность, выделяющиеся гормоны замедлят или остановят роды – давая ей время спастись и найти безопасное место для родов.
Эпидуральная анестезия снижает выработку катехолмаинов, что может быть полезным, если собственный уровень этих гормонов у женщины слишком высокий. Однако при эпидуральной анестезии не так выражен и всплеск этих гормонов перед потугами, что может вызывать как трудности с вытуживанием, так и увеличение риска инструментального родоразрешения (вакуум-экстракции и наложения щипцов).
Влияние на родовой процесс
Эпидуральная анестезия замедляет родовую деятельность, возможно за счет вышеуказанных гормональных эффектов, однако есть свидетельства из исследований на животных, что местные анестетики могут препятствовать развитию схваток, влияя непосредственно на мышцы матки (17).
В среднем, при использовании эпидуральной анестезии первый период родов удлиняется на 26 минут, второй период – на 15 минут (18). Уменьшение пика окситоцина удваивает риск использования щипцов и вакуума (18), хотя здесь могут быть вовлечены и другие механизмы.
Например, эпидуральная анестезия парализует мышцы тазового дна рожающей женщины, которые помогают головке ребенка занять правильное положение. При эпидуральной анестезии дети в 4 раза чаще оказываются в устойчивом заднем виде на заключительных этапах родов: в 13% случаев по сравнению с 3% при естественных родах (19). Такая позиция уменьшает вероятность спонтанных вагинальных родов. В одном исследовании (20) только 26% первородящих (и 57% повторнородящих) смогли родить вагинально – в остальных случаях роды завершились инструментально или кесаревым сечением.
Анестезиологи надеялись, что уменьшение дозы препараты или применение комбинации спинальной и эпидуральной анестезии уменьшат статистическую вероятность инструментального родоразрешения, но разница оказывается незначительной. В исследовании 2001 года (21) сравнивали разные виды эпидуральной анестезии: 37% женщин со стандартной дозой эпидуральной анестезии перенесли инструментальные роды, по сравнению с 29% женщин, получивших пониженную дозировку и 28% женщин, получивших комбинированную спинально-эпидуральную анестезию.
Инструментальное родоразрешение увеличивает риск (22) кратковременных осложнений для ребенка: кровоподтеки, травмы лица, смещение костей черепа, кефалогематомы (скопление крови под кожей головы). По данным некоторых исследований (23), у детей, рожденных с применением щипцов, в 4 раза повышается риск кровоизлияния в мозг; однако другие исследования (24, 25) не обнаруживают существенной разницы между детьми, рожденными естественно или с применением щипцов, в возрасте 5 лет. Еще одно исследование показало, что в случае наложения щипцов врачу потребуется применить вдвое большую силу, чтобы помочь ребенку родиться, если в родах была использована эпидуральная анестезия, в сравнении с безмедикаментозными родами (26).
Применение эпидуральной анестезии увеличивает потребность во введении искусственного окситоцина для усиления родовой деятельности, в связи с тем, что анестетик снижает выработку собственного гормона у женщины. Исследования говорят о троекратном увеличении частоты применения окситоцина (18). Сочетание анестезии и искусственного окситоцина (каждый из которых сам по себе может вызывать изменения сердцебиения ребенка, свидетельствующие о развитии дистресс-синдрома) значительно увеличивает риск оперативного родоразрешения (щипцы, вакуум, КС). По данным австралийского исследования, около половины первородящих женщин, получивших синтетический окситоцин вместе с эпидуральной анестезией, родили при помощи операции (27).
Взаимосвязь эпидуральной анестезии с последующим кесаревым сечением остается спорным моментом. Различные недавние обзоры имеют противоречивые сведения: в одном исследовании не предполагается значительного повышения риска (18), другое сообщает об увеличении этого риска на 50% (28). Вероятно, наиболее значительное влияние эпидуральная анестезия оказывает на женщин, рожающих своего первого ребенка (29).
Обратите внимание, что большинство упомянутых работ – рандомизированные контролируемые исследования, в которых участники распределяются случайным образом по группам различного медикаментозного обезболивания (ЭА или опиаты, например, меперидин). Многие из этих исследований содержат погрешность перекрестного влияния тех, у кого не ожидалась эпидуральная анестезия, но все же была выполнена, и наоборот. Стоит отметить, что в этих исследованиях нет контрольных групп – женщин, которые вообще не использовали медикаментозные методы обезболивания, а значит, мы не можем достоверно оценить влияние эпидуральной анестезии на роды в сравнении с родами без аналгезии.
Побочные эффекты эпидуральной анестезии
Лекарственные вещества, использующиеся при эпидуральной анестезии, достаточно сильны, чтобы обездвижить нижнюю часть тела женщины, так что не удивительно, что побочные эффекты можно наблюдать как у матери, так и у ребенка. Они варьируются от незначительных до угрожающих жизни и в некоторой степени зависят от свойств используемых лекарственных средств.
Большинство побочных эффектов, о которых будет идти речь ниже, не уменьшились при применении низкодозной или «ходячей» ЭА, поскольку женщины все еще получают солидные дозы локальных анестетиков, особенно при использовании некоторых форм введения (21). Добавление опиатов в ЭА или комбинированную спинально-эпидуральную анестезию может создать дополнительные риски для матери, такие как кожный зуд или угнетение дыхания (см.ниже).
Побочные эффекты для матери
Самым часто встречающимся побочным эффектом является снижение артериального давления. Как правило, для предупреждения этой ситуации женщине ставят капельницу с физраствором до введения анестезии. Но даже при этом условии гипотония возникает почти у половины женщин с ЭА (30, 31), особенно в первые минуты после введения лекарств. Снижение артериального давления в свою очередь вызывает различные осложнения, начиная от слабости до внезапной остановки сердца(32), а также влияет на кровоснабжение ребенка (см.ниже). Лечение гипотензии заключается в дополнительном введении жидкостей, а в тяжелых случаях – инъекцией адреналина.
Также к основным побочным эффектам, возникающим при использовании эпидуральной анестезии, относятся:
- неспособность самостоятельно опорожнить мочевой пузырь (с необходимостью установки мочевого катетера) приблизительно у двух третей женщин (31);
- кожный зуд, который возникает примерно у двух третей женщин с комбинацией опиатов и ЭА (30, 31);
- озноб у каждой третьей женщины (33);
- угнетение сознания у каждой пятой женщины (31);
- тошнота и рвота, в 5 % случаев (31).
Эпидуральная анестезия в 5 раз чаще вызывает подъем температуры у рожениц до 38° (18). Лихорадка чаще встречается у первородящих женщин и зависит от времени использования анестезии (28). Например, есть данные (34), что через 6 часов после установки ЭА температура поднимается у 7% первородящих, а через 18 часов их количество увеличивается до 36%. Лихорадка у матери может оказывать существенное влияние на ребенка (см. ниже).
Опиаты, особенно введённые непосредственно в спинномозговое пространство, могут вызвать непредсказуемые трудности с дыханием у матери, которые могут проявиться через несколько часов после родов и прогрессировать до очень серьезных состояний. Один из авторов исследований комментирует: «Нарушения дыхания является одним из самых опасных и непредсказуемых последствий при введении спинальной анельгезии» (35).
Многие исследования обнаруживают связь между эпидуральной анестезией и послеродовыми кровотечениями (36-41). Крупное исследование в Великобритании показало, что послеродовое кровотечение в 2 раза чаще возникает у женщин, которые использовали эпидуральную анестезию в родах (36). Это может быть связано как с бОльшим количеством инструментальных родоразрешений и травм промежности, так и с гормональными изменениями при применении ЭА, описанными выше, включая повышенный риск применения синтетического окситоцина.
Эпидуральная анестезия не оказывает обезболивающего эффекта на 10-15% женщин (30), и в 5% случаев требуется повторная установка катетера (42). В 1% случаев повреждается твердая мозговая оболочка, что вызывает сильнейшую головную боль на протяжении до 6 недель и лечится инъекциями в эпидуральное пространство (43, 44).
Более серьезные побочные эффекты встречаются крайне редко. Как правило, они проявляются в случае непреднамеренного введения анестетиков в кровяное русло и могут проявляться токсическими эффектами, такими как невнятная речь, сонливость, при высоких дозировках могут развиться судороги. Это происходит примерно в одном случае из 2800 (42). Угрожающие жизни реакции встречаются в одном случае из 4000 (32, 42, 45, 46).
Смерть, связанная с эпидуральной анестезией, в акушерстве бывает крайне редко и может быть вызвана остановкой сердца или дыхания, либо абсцессом в эпидуральном пространстве, который может развиться в течение нескольких дней или недель после родов (47).
Более поздние последствия, такие как слабость и онемение нижних конечностей, наблюдаются у 4-18 из 10000 женщин, большинство из них спонтанно проходят в течение 3 месяцев (32, 45-48).
Отсроченные осложнения либо постоянные патологические изменения могут развиваться вследствие повреждения нерва во время установки катетера; при возникновении абсцесса или тромба, давящих на спинной мозг; а также от токсических реакций в оболочках спинного мозга, которые в свою очередь могут привести к параличу нижних конечностей (32).
Побочные эффекты у ребенка
Некоторые из наиболее значимых и хорошо изученных побочных эффектов, наблюдающихся у плода и новорожденного младенца, происходят от тех изменений, которым оказывается подвержена мать. Как мы уже говорили, это изменения ее гормонального фона, артериального давления и температуры. Лекарства, применяемые для ЭА, могут и напрямую вызывать токсические эффекты у плода и младенца – и их концентрация может оказаться даже выше, чем у матери (49).
Изменение сердечного ритма у плода
Эпидуральная анестезия может вызывать изменения в сердечном ритме плода, что является признаком недостатка кровообращения и кислородного голодания. Этот эффект часто наблюдается вскоре после введения анестезии (обычно в первые 30 минут), может длиться около 20 минут, и более вероятны такие проявления при применении опиатов для эпидуральной или спинальной анестезии. Большинство изменений ритма проходят спонтанно, при изменении положения тела женщины, и лишь в редких случаях требуют медикаментозной коррекции (50). Более серьезные нарушения ритма и развивающийся впоследствии дистресс-синдром требуют проведения экстренного кесарева сечения.
Следует отметить, что применение опиатов само по себе может привести к аномальным изменениям сердечного ритма. Поэтому реальный эффект именно эпидуральной анестезии на сердечный ритм плода достаточно трудно оценить, так как почти во всех рандомизированных исследованиях для ЭА используются препараты с промедолом и другими опиатами.
Некоторые исследователи отмечают, что положение «лежа на спине» чаще сопровождается гипотензией и изменениями сердечного ритма плода, если у женщины стоит эпидуральная анестезия (51). Другие исследования показывают, что положение «лежа на спине» в сочетании с ЭА ассоциировано с недостатком поступление кислорода к мозгу ребенка (52).
Влияние повышенной температуры матери
На малыша может оказать влияние лихорадка матери, вызванная эпидуральной анестезией. В одном крупном исследовании первородящих женщин сравнивали детей, рожденных матерями с нормальной температурой тела и детей, рожденных от фебрильных матерей (у 97% из них была использована ЭА). Дети фебрильных матерей чаще рождались с более низкими баллами по шкале Апгар, имели худшие показания сердечного ритма, им чаще требовались реанимационные мероприятия (в 11,5% случаев по сравнению с 3%), и у них чаще наблюдались судороги в периоде новорожденности (53). Другое исследование отмечает десятикратное увеличение энцефалопатии новорожденных (признак повреждения мозга) у младенцев, рожденных от матерей с лихорадкой (54).
Материнская лихорадка в родах может напрямую вызывать проблемы у новорожденных. Поскольку повышенная температура может быть признаком инфекции в матке, то детей, рожденных от фебрильных матерей, практически всегда наблюдают на предмет развития инфекции (сепсиса). Для этого используют длительное раздельное пребывание матери и ребенка (часто в палатах интенсивной терапии), инвазивные тесты для определения наличия инфекции, и, чаще всего, введение антибиотиков до тех пор, пока не будут готовы результаты анализов. Согласно данным другого исследования первородящих матерей, у 34% младенцев, получивших ЭА, впоследствии развился сепсис, в то время как в группе новорожденных без ЭА частота развития этого осложнения составила всего 9,8% (53).
Токсичность
Каждое лекарственное вещество, получаемое матерью во время родов, поступает через плаценту к ребенку, который более подвержен токсическим эффектам. Максимальное действие проявляется при рождении и в течение нескольких часов после, когда концентрации лекарств максимальны.
Существует несколько исследований, посвященных влиянию ЭА на новорожденного младенца, но почти все из них сравнивают таких детей с детьми, подвергшимися воздействию опиатов во время родов (которые вызывают сонливость и трудности с дыханием). Эти исследования показывают небольшую разницу между детьми с ЭА и без нее (но обычно под воздействием опиатов) в показателях по шкале Апгар или рH (показатель кислотно-щелочного баланса) пуповины – оба показателя отражают состояния ребенка (28). Тем не менее, в большом популяционном исследовании в Швеции было показано, что использование ЭА сопряжено с низкими баллами по шкале Апгар сразу после родов (55).
Также есть несколько исследований о токсичности для новорожденных лекарственных веществ, применяемых при ЭА, и особенно опиатов (56). Токсические эффекты опиатов чаще проявляются у новорожденных при использовании режимов с высокими дозами лекарств, особенно если мама сама может регулировать поступление дополнительных доз лекарства. Также отмечена широкая вариабельность индивидуальной чувствительности младенцев (56).
Важно отметить, что способность малыша метаболизировать и выводить лекарственные вещества значительно ниже, чем у взрослого. Например, период полураспада (время, за которое сывороточная концентрация вещества снижается вдвое) для местного анестетика Бупивакаина составляет 8,1 часов для новорожденного и 2,7 часа для матери (57). Кроме того, содержание вещества в крови может не отражать в достаточной степени уровень токсического эффекта на организм ребенка, т.к. лекарство может накапливаться в тканях новорожденного – его мозге и печени (49) и медленнее из них выводиться (58).
В недавнем обзоре было отмечено учащение проявления желтухи у новорожденных, подвергшихся действию эпидуральной анестезии, что может быть связано с инструментальным родоразрешением или использованием синтетического окситоцина (28).
Побочные эффекты, влияющие на поведение детей
Влияние препаратов эпидуральной анестезии на нейроповедение (поведение, отражающее состояние мозга) до конца не определено. Старые исследования, в которых детей с ЭА сравнивали с детьми, рожденными без использования каких-либо лекарств, показывали значительные нейроповеденческие эффекты ЭА. Однако более новые рандомизированные контролируемые исследования, в которых, напомним, детей с ЭА сравнивают с детьми, получившими воздействие опиатами, не находят никаких различий. Однако в более ранних работах для оценки нейроповедения детей используется NBAS – более всеобъемлющий и более сложный в применении тест, разработанный педиатрами, тогда как современные исследования применяют менее сложные тесты, например, NACS, разработанный анестезиологами. NACS собирает все данные о ребенке в одну диаграмму, и его часто критикуют за нечувствительность и ненадежность (59-61).
Например, все три исследования, сравнивающие детей с ЭА и детей без каких-либо лекарств, и использующие NBAS для оценки состояния детей, обнаружили статистически значимые различия между группами (28).
Энн Мюррей с соавторами сравнивали 15 детей, рожденных без применения каких-либо лекарств и 40 детей, подвергшихся влиянию ЭА, и обнаружили, что дети второй группы даже по прошествии пяти дней после родов все еще имели более низкие баллы по тесту NBAS, и испытывали большие сложности с контролем своего состояния. Те 20 детей, матери которых помимо ЭА получали в родах и окситоцин, имели еще более низкие баллы NBAS, что можно объяснить более высокой частотой желтухи. Через месяц после родов мамы с ЭА считали своих малышей «менее адаптированными, более напряженными и более беспокойными». Эти различия не могут быть объяснены более трудными родами и последующей сепарацией, обусловленной применением ЭА (62).
Кэрол Сепкоски с соавторами в сравнительном анализе двух групп по 20 детей (с применением ЭА и без воздействия лекарств) обнаружили меньшую способность ориентироваться и настороженность в течение первого месяца жизни у детей, рожденных под эпидуральной анестезией. Мамы этих детей проводили с ними меньше времени в роддоме, и это время было прямо пропорционально полученной дозе бупивакаина (63).
Дебора Розенблат оценивала по шкале NBAS детей, рожденных с применением ЭА, в течение 6 недель и наиболее низкие баллы наблюдала в первый день после родов. Несмотря на тенденцию к улучшению состояния, через три дня после родов дети с ЭА плакали чаще и в ответ на меньшие раздражители; определенные признаки этого состояния сохранялись на протяжении всех шести недель наблюдения (64).
Несмотря на то, что в более ранних исследованиях применялась традиционная ЭА (с блоком как чувствительных, так и моторных нервов), общая доза анестетика, получаемая матерями (61,6 мг (62), 112,7 мг (63) и 119,8 мг (64) соответственно), в значительной степени сопоставима с теми дозами, которые получали матери в более новых исследованиях (67,5 мг (49), 91,1 мг (65) и 101,1 мг (21)).
Эти нейроповеденческие исследования подчеркивают возможное влияние эпидуральной анестезии на новорожденных и на формирование отношений между мамой и малышом. Во всех статьях исследователи выражают свою озабоченность «Важностью первого контакта с такими младенцами в формировании материнских ожиданий и типа взаимоотношений между ними» (62).
Исследования на животных
Исследования на животных наводят на мысль, что описанные выше нарушения гормонального фона матери, обусловленные применение ЭА, могут способствовать трудностям в контакте между мамой и младенцем. Исследования показывают, что ЭА вызывает нарушения привязанности между овцами и их новорожденными ягнятами, особенно в случаях, когда роды были первыми и ЭА применялась с самого начала родов (66).
Не существует долгосрочных исследований влияния эпидуральной анестезии на потомство человека. Однако исследования с некоторыми близкородственными животными вызывают беспокойство. Ученые Голуб и Германн применяли бупивакаин для ЭА в родах макак-резус, а затем следили за развитием родившихся макак в течение 12 месяцев (что эквивалентно четырем годам у человека). Они обнаружили определенные нарушениях на основных этапах развития у этих обезьянок: через шесть-восемь недель после родов их манипуляторная активность (способность удерживать предметы и вертеть их в верхних конечностях – прим.пер.) развивалась медленнее, а в десять месяцев наблюдалось замедленное развитие моторных навыков (67). Авторы приходят к выводу: «Эти эффекты могут быть как результатом воздействия на уязвимые процессы в мозге в течение чувствительного периода, так и результатом воздействия на нормальное развитие мозга эндогенных факторов либо изменений в раннем опыте» (68).
Грудное вскармливание
Влияние анестезии на грудное вскармливание плохо изучено и поздние рандомизированные контролируемые исследования (сравнивающие группы с ЭА и с воздействием опиатами) могут сильно ввести в заблуждение, поскольку хорошо известно негативное воздействие опиатов на раннее начало грудного вскармливания и его успешность (69-73).
Существует несколько механизмов, которыми ЭА может повлиять на опыт кормления и успешность ГВ. Во-первых, из-за ЭА у ребенка может быть нарушено нейроповедение и это влияние наиболее выражено в первые часы после родов, в критический для начала грудного вскармливания момент. Недавние исследования установили, что чем выше состояние младенца по оценкам нейроповеденческих тестов, тем успешнее будет грудное вскармливание (74).
В другом исследовании, баллы младенцев по шкале IBFAT (способ оценки поведения новорожденных у груди во время грудного вскармливания – прим.пер.) были наиболее высокими в группе детей, рожденных в безмедикаментозных родах; ниже – у детей, получивших воздействие ЭА или опиатов; и самые низкие баллы наблюдались у тех младенцев, в родах которых использовались и ЭА, и опиаты. Дети с более низкими баллами раньше отлучались от груди, хотя их показатели мало отличались от других детей в течение 6 недель (75). В другом исследовании говорится, что дети, подвергшиеся влиянию спинальной или эпидуральной анестезии, теряли бОльший вес в роддоме, хотя это может отражать проблемы с грудным вскармливанием, например, неэффективное сосание (76). Еще одно исследование показало, что баллы IBFAT и NACS (см.выше) могут оставаться нормальными, если в родах применялись очень низкие дозы ЭА, хотя в этом же исследовании было показано, что при более высоких дозировках ЭА баллы по шкале NACS при оценке младенцев через два часа после родов были ниже (77).
Во-вторых, ЭА может осложнять грудное вскармливание для самой женщины. Это более вероятно, если женщина прошла через долгие или инструментальные роды, или при раздельном пребывании с ребенком – а такие ситуации часто являются следствием ЭА. Гормональные изменения также способствуют трудностям с ГВ, поскольку окситоцин – главный гормон лактации.
Дети, рожденные при использовании анестезии, с меньшей вероятностью находятся на исключительно грудном вскармливании при выписке из стационара, особенно это касается тех детей, которых не приложили к груди в первый час жизни (78). Опрос женщин в Финляндии показывает, что 67% женщин, рожающих с ЭА, уже к 12 неделям жизни ребенка имеют смешанное или искусственное вскармливание, по сравнению с 29% среди родивших без обезболивания. Также первые чаще говорят о «нехватке молока» (79).
Две группы шведских исследователей изучали тонкости поведения у груди и перед кормлением у детей, рожденных без применения ЭА. Одна группа детей при контакте с мамой кожа-к-коже начинали ползти по направлению к груди, сами находили сосок и самостоятельно прикладывались (69). Те малыши, в родах которых применялись опиаты, или которые были разлучены с мамой вскоре после рождения, во многом утеряли такое поведение. Другая группа шведских ученых изучала детей, подвергшихся воздействию анестезии в родах (чаще всего опиатов, но были и малыши с ЭА) и пришла к выводу, что у таких младенцев нарушено поведение, предшествующее сосанию груди (массаж и лизание соска), а также сосание кулачков – в сравнении с детьми, рожденными в безмедикаментозных родах (71).
Чувство удовлетворения от родов
Проживание боли в родах – один из самых важных вопросов для женщин, и акушеры уверены, что адекватное обезболивание способно обеспечить положительный опыт родов. Однако на деле получается наоборот – несколько исследований показали, что женщины, не применявшие медикаментозное обезболивание в родах, были более удовлетворены своим опыт сразу после родов (80), через 6 недель (81) и даже по прошествии года (82). В Великобритании 1000 опрошенных женщин, получивших эпидуральную анестезию в родах, говорили о высоком уровне облегчения боли, но о низкой удовлетворенности процессом, вероятно в связи с наибольшим количеством медицинских вмешательств.
И наконец, следует отметить, что использование анестезии и прочих медицинских процедур во многом диктуется персоналом роддома. В одном исследовании было выявлено, что в родах с семейными врачами реже использовались эпидуральное обезболивание, КТГ и синтетический окситоцин, вероятность кесарева сечения и реанимации ребенка также была ниже (83).
Выводы
Эпидуральная анестезия при наличии некоторых плюсов несет в себе значительные риски, которые подробно описаны в медицинской литературе, но часто не могут быть разъяснены рожающей женщине в полной мере. Выбор врача, который разделяет и поддерживает идею естественных безмедикаментозных родов, может помочь женщинам избежать родов с применением ЭА.
Источники:
1. G. R. Hamilton and T. F. Baskett, “In the Arms of Morpheus: The Development of Morphine for Postoperative Pain Relief,” Can J Anaesth 47, no. 4 (2000): 367–74.
2. E. Declercq et al., Listening to Mothers: Report of the First U.S. National Survey of Women’s Childbearing Experiences (New York: Maternity Center Association, October 2002): pg 1
3. Canadian Institute for Health Information, Giving Birth in Canada (Ontario: CIHA, 2004): pg 7
4. National Health Service, NHS Maternity Statistics, England: 2002–03 (Crown Copyright, 2004): pg 6
5. E. D. Hodnett, “Pain and Women’s Satisfaction with the Experience of Childbirth: A Systematic Review,” Am J Obstet Gynecol 186, Supplement 5: Nature (2002): S160–S172.
6. S. J. Buckley, “Ecstatic Birth: Nature’s Hormonal Blueprint for Labor,” Mothering no. 111 (March–April 2002)
7. World Health Organization, Care in Normal Birth: A Practical Guide. Report of a Technical Working Group (Geneva: World Health Organization, 1996): 16.
8. V. A. Rahm et al., “Plasma Oxytocin Levels in Women During Labor With or Without Epidural Analgesia: A Prospective Study,” Acta Obstet Gynecol Scand 80, no. 11 (2002): 1033–1039.
9. R. M. Stocche et al., “Effects of Intrathecal Sufentanil on Plasma Oxytocin and Cortisol Concentrations in Women During the First Stage of Labor,” Reg Anesth Pain Med 26, no. 6 (2001): 545–550.
10. C. F. Goodfellow et al., “Oxytocin Deficiency at Delivery with Epidural Analgesia,” Br J Obstet Gynaecol 90, no. 3 (1983): 214–219.
11. O. Behrens et al., “Effects of Lumbar Epidural Analgesia on Prostaglandin F2 Alpha Release and Oxytocin Secretion During Labor,” Prostaglandins 45, no. 3 (1993): 285–296.
12. R. Jouppila et al., “Maternal and Umbilical Venous Plasma Immunoreactive Beta-Endorphin Levels During Labor With and Without Epidural Analgesia,” Am J Obstet Gynecol 147, no. 7 (1983): 799–802.
13. T. J. Scull et al., “Epidural Analgesia in Early Labour Blocks the Stress Response but Uterine Contractions Remain Unchanged,” Can J Anaesth 45, no. 7 (1998): 626–630.
14. A. Costa et al., “Adrenocorticotropic Hormone and Catecholamines in Maternal, Umbilical and Neonatal Plasma in Relation to Vaginal Delivery,” J Endocrinol Invest 11, no. 10 (1988): 703–709.
16. 15 M. Odent, “The Fetus Ejection Reflex,” in The Nature of Birth and Breastfeeding (Sydney: Ace Graphics, 1992): 29–43.
16. R. P. Lederman et al., “Anxiety and Epinephrine in Multiparous Women in Labor: Relationship to Duration of Labor and Fetal Heart Rate Pattern,” Am J Obstet Gynecol 153, no. 8 (1985): 870–877.
17. G. Arici et al., “The Effects of Bupivacaine, Ropivacaine and Mepivacaine on the Contractility of Rat Myometrium,” Int J Obstet Anesth 13, no. 2 (2004): 95–98.
18. B. L. Leighton and S. H. Halpern, “The Effects of Epidural Analgesia on Labor, Maternal, and Neonatal Outcomes: A Systematic Review,” Am J Obstet Gynecol 186, Supplement 5: Nature (2002): S69–S77.
19. E. Lieberman et al., “Changes in Fetal Position During Labor and their Association with Epidural Analgesia,” Obstet Gynecol 105, no. 5 (2005): 974–982.
20. S. E. Ponkey et al., “Persistent Fetal Occiput Posterior Position: Obstetric Outcomes,” Obstet Gynecol 101, no. 5, pt. 1 (2003): 915–920.
21. COMET Study Group UK, “Effect of Low-Dose Mobile versus Traditional Epidural Techniques on Mode of Delivery: A Randomised Controlled Trial,” Lancet 358, no. 9275 (2001): 19–23.
22. J. H. Johnson et al., “Immediate Maternal and Neonatal Effects of Forceps and Vacuum-Assisted Deliveries,” Obstet Gynecol 103, no. 3 (2004): 513–518.
23. B. S. Jhawar et al., “Risk Factors for Intracranial Hemorrhage Among Full-Term Infants: A Case-Control Study,” Neurosurgery 52, no. 3 (2003): 581–590 (discussion, 588–590).
24. W. G. McBride et al., “Method of Delivery and Developmental Outcome at Five Years of Age,” Med J Aust 1, no. 8 (1979): 301–304.
25. B. D. Wesley et al., “The Effect of Forceps Delivery on Cognitive Development,” Am J Obstet Gynecol 169, no. 5 (1993): 1091–1095.
26. S. H. Poggi et al., “Effect of Epidural Anaesthesia on Clinician-Applied Force During Vaginal Delivery,” Am J Obstet Gynecol 191, no. 3 (2004): 903–906.
27. C. L. Roberts et al., “Rates for Obstetric Intervention Among Private and Public Patients in Australia: Population Based Descriptive Study,” Br Med J 321, no. 7254 (2000): 137–141.
28. E. Lieberman and C. O’Donoghue, “Unintended Effects of Epidural Analgesia During Labor: A Systematic Review,” Am J Obstet Gynecol 186, Supplement 5: Nature (2002): S31–S68.
29. J. A. Thorp et al., “The Effect of Continuous Epidural Analgesia on Cesarean Section for Dystocia in Nulliparous Women,” Am J Obstet Gynecol 161, no. 3 (1989): 670–675.
30. L. M. Goetzl, “Obstetric Analgesia and Anesthesia,” ACOG Practice Bulletin, Clinical Management Guidelines for Obstetrician-Gynecologists no. 36, Obstet Gynecol 100, no. 1 (July 2002): 177–191.
31. L. J. Mayberry et al., “Epidural Analgesia Side Effects, Co-Interventions, and Care of Women During Childbirth: A Systematic Review,” Am J Obstet Gynecol 186, Supplement 5: Nature (2002): S81–S93.
32. D. B. Scott and B. M. Hibbard, “Serious Non-Fatal Complications Associated with Extradural Block in Obstetric Practice,” Br J Anaesth 64, no. 5 (1990): 537–541.
33. D. Buggy and J. Gardiner, “The Space Blanket and Shivering During Extradural Analgesia in Labour,” Acta Anaesthesiol Scand 39, no. 4 (1995): 551–553.
34. E. Lieberman et al., “Epidural Analgesia, Intrapartum Fever, and Neonatal Sepsis Evaluation,” Pediatrics 99, no. 3 (1997): 415–419.
35. P. DeBalli and T. W. Breen, “Intrathecal Opioids for Combined Spinal-Epidural Analgesia During Labour,” CNS Drugs 17, no. 12 (2003): 889–904 (892–893).
36. N. S. Saunders et al., “Neonatal and Maternal Morbidity in Relation to the Length of the Second Stage of Labour,” Br J Obstet Gynaecol 99, no. 5 (1992): 381–385.
37. L. St. George and A. J. Crandon, “Immediate Postpartum Complications,” Aust NZ J Obstet Gynaecol 30, no. 1 (1990): 52–56.
38. E. F. Magann et al., “Postpartum Hemorrhage after Vaginal Birth: An Analysis of Risk Factors,” South Med J 98, no. 4 (2005): 419–422.
39. T. M. Eggebo and L. K. Gjessing, [“Hemorrhage After Vaginal Delivery”], Tidsskr Nor Laegeforen 120, no. 24 (2000): 2860–2863
40. B. Ploeckinger et al., “Epidural Anaesthesia in Labour: Influence on Surgical Delivery Rates, Intrapartum Fever and Blood Loss,” Gynecol Obstet Invest 39, no. 1 (1995): 24–27.
41. L. Gilbert et al., “Postpartum Haemorrhage: A Continuing Problem,” Br J Obstet Gynaecol 94, no. 1 (1987): 67–71.
42. M. J. Paech et al., “Complications of Obstetric Epidural Analgesia and Anaesthesia: A Prospective Analysis of 10,995 Cases,” Int J Obstet Anesth 7, no. 1 (1998): 5–11.
43. P. C. Stride and G. M. Cooper, “Dural Taps Revisited: A 20-Year Survey from Birmingham Maternity Hospital,” Anaesthesia 48, no. 3 (1993): 247–255.
44. S. N. Costigan and J. S. Sprigge, “Dural Puncture: The Patients’ Perspective. A Patient Survey of Cases at a DGH Maternity Unit 1983–1993,” Acta Anaesthesiol Scand 40, no. 6 (1996): 710–714.
45. D. B. Scott and M. E. Tunstall, “Serious Complications Associated with Epidural/Spinal Blockade in Obstetrics: A Two-Year Prospective Study,” Int J Obstet Anesth 4, no. 3 (1995): 133–139.
46. J. S. Crawford, “Some Maternal Complications of Epidural Analgesia for Labour,” Anaesthesia 40, no. 12 (1985): 1219–1225.
47. F. Reynolds, “Epidural Analgesia in Obstetrics,” Br Med J 299, no. 6702 (1989): 751–752.
48. MIDIRS and The NHS Centre for Reviews and Dissemination, “Epidural Pain Relief During Labour,” in Informed Choice for Professionals (Bristol: MIDIRS, 1999): pg 5
49. R. Fernando et al., “Neonatal Welfare and Placental Transfer of Fentanyl and Bupivacaine During Ambulatory Combined Spinal Epidural Analgesia for Labour,” Anaesthesia 52, no. 6 (1997): 517–524.
50. J. Littleford, “Effects on the Fetus and Newborn of Maternal Analgesia and Anesthesia: A Review,” Can J Anaesth 51, no. 6 (2004): 586–609.
51. G. Capogna, “Effect of Epidural Analgesia on the Fetal Heart Rate,” Eur J Obstet Gynecol Reprod Biol 98, no. 2 (2001): 160–164.
52. C. J. Aldrich et al., “The Effect of Maternal Posture on Fetal Cerebral Oxygenation During Labour,” Br J Obstet Gynaecol 102, no. 1 (1995): 14–19.
53. E. Lieberman et al., “Intrapartum Maternal Fever and Neonatal Outcome,” Pediatrics 105, no. 1, pt. 1 (2000): 8–13.
54. L. Impey et al., “Fever in Labour and Neonatal Encephalopathy: A Prospective Cohort Study,” Br J Obstet Gynaecol 108, no. 6 (2001): 594–597.
55. K. Thorngren-Jerneck and A. Herbst, “Low 5-Minute Apgar Score: A Population-Based Register Study of 1 Million Term Births,” Obstet Gynecol 98, no. 1 (2001): 65–70.
56. M. Kumar and B. Paes, “Epidural Opioid Analgesia and Neonatal Respiratory Depression, J Perinatol 23, no. 5 (2003): 425–427.
57. T. Hale, Medications and Mother’s Milk (Amarillo, TX: Pharmasoft, 1997): {pg.#s?}. p 76
58. T. Hale, “The Effects on Breastfeeding Women of Anaesthetic Medications Used During Labour,” The Passage to Motherhood Conference, Brisbane, Australia (1998),
59. W. Camann and T. B. Brazelton, “Use and Abuse of Neonatal Neurobehavioral Testing,” Anesthesiology 92, no. 1 (2000): 3–5.
60. R. Gaiser, “Neonatal Effects of Labor Analgesia,” Int Anesthesiol Clin 40, no. 4 (2002): 49–65.
61. S. H. Halpern et al., “The Neurologic and Adaptive Capacity Score is Not a Reliable Method of Newborn Evaluation,” Anesthesiology 94, no. 6 (2001): 958–962.
62. A. D. Murray et al., “Effects of Epidural Anesthesia on Newborns and their Mothers,” Child Dev 52, no. 1 (1981): 71–82.
63. C. M. Sepkoski et al., “The Effects of Maternal Epidural Anesthesia on Neonatal Behavior During the First Month,” Dev Med Child Neurol 34, no. 12 (1992): 1072–1080.
64. D. B. Rosenblatt et al., “The Influence of Maternal Analgesia on Neonatal Behaviour: II. Epidural Bupivacaine,” Br J Obstet Gynaecol 88, no. 4 (1981): 407–413.
65. J. R. Loftus et al., “Placental Transfer and Neonatal Effects of Epidural Sufentanil and Fentanyl Administered with Bupivacaine During Labor,” Anesthesiology 83, no. 3 (1995): 300–308.
66. D. Krehbiel et al., “Peridural Anesthesia Disturbs Maternal Behavior in Primiparous and Multiparous Parturient Ewes,” Physiol Behav 40, no. 4 (1987): 463–472.
67 M. S. Golub and S. L. Germann, “Perinatal Bupivacaine and Infant Behavior in Rhesus Monkeys,” Neurotoxicol Teratol 20, no. 1 (19.98): 29–41.
68. M. S. Golub, “Labor Analgesia and Infant Brain Development,” Pharmacol Biochem Behav 55, no. 4 (1996): 619–628 (619).
69. L. Righard and M. O. Alade, “Effect of Delivery Room Routines on Success of First Breast-Feed,” Lancet 336, no. 8723 (1990): 1105–1107.
70. M. K. Matthews, “The Relationship Between Maternal Labour Analgesia and Delay in the Initiation of Breastfeeding in Healthy Neonates in the Early Neonatal Period,” Midwifery 5, no. 1 (1989): 3–10.
71. A. B. Ransjo-Arvidson et al., “Maternal Analgesia During Labor Disturbs Newborn Behavior: Effects on Breastfeeding, Temperature, and Crying,” Birth 28, no. 1 (2001): 5–12.
72. E. Nissen et al., “Effects of Maternal Pethidine on Infants’ Developing Breast Feeding Behaviour,” Acta Paediatr 84, no. 2 (1995): 140–145.
73. L. Rajan, “The Impact of Obstetric Procedures and Analgesia/Anaesthesia During Labour and Delivery on Breast Feeding,” Midwifery 10, no. 2 (1994): 87–103.
74. S. Radzyminski, “Neurobehavioral Functioning and Breastfeeding Behavior in the Newborn,” J Obstet Gynecol Neonatal Nurs 34, no. 3 (2005): 335–341.
75. J. Riordan et al., “The Effect of Labor Pain Relief Medication on Neonatal Suckling and Breastfeeding Duration,” J Hum Lact 16, no. 1 (2000): 7–12.
76. K. G. Dewey et al., “Risk Factors for Suboptimal Infant Breastfeeding Behavior, Delayed Onset of Lactation, and Excess Neonatal Weight Loss,” Pediatrics 112, no. 3, pt. 1 (2003): 607–619.
77. S. Radzyminski, “The Effect of Ultra Low Dose Epidural Analgesia on Newborn Breastfeeding Behaviors,” J Obstet Gynecol Neonatal Nurs 32, no. 3 (2003): 322–331.
78. D. J. Baumgarder et al., “Effect of Labor Epidural Anesthesia on Breast-Feeding of Healthy Full-Term Newborns Delivered Vaginally,” J Am Board Fam Pract 16, no. 1 (2003): 7–13.
79. P. Volmanen et al., “Breast-Feeding Problems After Epidural Analgesia for Labour: A Retrospective Cohort Study of Pain, Obstetrical Procedures and Breast-Feeding Practices,” Int J Obstet Anesth 13, no. 1 (2004): 25–29.
80. S. Kannan et al., “Maternal Satisfaction and Pain Control in Women Electing Natural Childbirth,” Reg Anesth Pain Med 26, no. 5 (2001): 468–472.
81. J. M. Green et al., “Expectations, Experiences, and Psychological Outcomes of Childbirth: A Prospective Study of 825 Women,” Birth 17, no. 1 (1990): 15–24.
82. B. M. Morgan et al., “Analgesia and Satisfaction in Childbirth (The Queen Charlotte’s 1000 Mother Survey),” Lancet 2, no. 8302 (1982): 808–810.
83. M. C. Klein et al., “Epidural Analgesia Use as a Marker for Physician Approach to Birth: Implications for Maternal and Newborn Outcomes,” Birth 28, no. 4 (2001): 243–248.
