Эпидуральная анестезия в родах [транскрипт]
Историческая справка
Впервые эпидуральная анестезия была применена еще в 19 веке на пациенте мужского пола (1885 год), и с тех пор периодически публиковались сообщения об успешном обезболивании родов, достигнутом при помощи инъекции кокаиновых препаратов в субарахноидальное пространство (1900 год). Авторы этих сообщений часто замечали тошноту, рвоту и головные боли как побочные эффекты, и только после описания техники, не требующей прокола твердой мозговой оболочки и использующая новокаин, частота этих эффектов стала уменьшаться (1909 год). В 1931 году впервые описано применение катетера, размещенного в каудальном эпидуральном пространстве, что позволяло добавлять анестетика, не выполняя повторный прокол. Постепенно техника совершенствовалась, синтезировались новые препараты для анестезии, и к 1970-1980 годам поясничная эпидуральная анестезия полностью сменила каудальную, а болюсное введение препаратов, уменьшение их дозировок и добавление опиоидов привело к уменьшению частоты побочных эффектов и большей безопасности процедуры. Постепенно такой метод обезболивания стали применять на протяжении все большей части родов (источник).
В настоящее время различают разные виды нейроаксиального обезболивания:
- при эпидуральной анестезии анестетик вводится в эпидуральное пространство, затем проникает в субарахноидальное пространство, где блокирует прохождение нервных импульсов по корешковым нервам и далее в спинной мозг. Приводит к длительному обезболиванию и потере двигательной активности
- при спинальной анестезии анестетик вводится в субарахноидальное пространство, и блокирование передачи импульсов происходит на уровне корешков спинно-мозговых нервов. Приводит к кратковременному обезболиванию, с минимальной блокадой двигательной активности
- при комбинированной спинально-эпидуральной анестезии происходит сочетание двух методов – анестетик вводится и в эпидуральное, и в спинальное пространство. Это происходит либо последовательно (при прохождении иглой сначала одного, а потом второго пространства), либо с использованием специальных игл, которые позволяют делать это одновременно. Комбинированная СЭА сочетает плюсы обоих видов анальгезии и позволяет уменьшить дозу вводимого анестетика
Российский протокол по нейроаксиальным методам обезболивания родов описывает эпидуральную, спинальную и комбинированную анальгезии, с применением таких препаратов, как ропивакаин, бупивакаин, лидокаин в качестве местных анестетиков и ипромедол при необходимости использования опиатов (для усиления анальгетического эффекта и уменьшения дозы местного анестетика) — но в протоколе есть указание, что «без крайней необходимости следует избегать их использования». Для пролонгирования эффекта местных анестетиков используется адреналин (имеются готовые формы местных анестетиков с адреналином).
За 20 лет с 1981 по 2001 использование эпидуральной анестезии в США утроилось. По данным исследования 2008 года, в США частота применения ЭА варьировалась среди женщин разной расы и национальности, и была самой высокой среди белых мам. Другое исследование показывает увеличение частоты применения ЭА с увеличением индекса массы тела мамы — у женщин с ИМТ выше 40 частота использования этого метода обезболивания достигала 73%.
Другие страны очень различаются между собой по частоте использования ЭА. И даже в одной и той же стране разные регионы могут показывать различия в несколько раз: так, например, на севере Италии большинство больниц предоставляет круглосуточную возможность бесплатной ЭА в родах, и там ее частота составляет около 38%. На юге же таких больниц меньшинство, и среди южных итальянок частота применения ЭА в родах составляет менее 10%.
В Японии самый низкий уровень обезболенных родов — там считается, что боль в родах — необходимый этап на пути материнства. При этом роды считаются нормальным процессом, и поскольку боль в них физиологична — то ее и не стоит убирать с помощью фармакологических методов. Только 160 клиник в Японии предлагают ЭА в родах, и в обществе сформировано демонизирующее представление об ЭА как о процедуре с высоким риском осложнений и смерти мамы и малыша — общая частота применения этого метода обезболивания в Японии составляет около 6%.
Чаще всего прибегают к помощи ЭА женщины из Франции и Финляндии — 83% и 89% соответственно.
Преимущества ЭА в родах
Среди преимуществ эпидуральной анестезии на первом месте конечно стоит само обезболивание родов, но это не единственный бонус, который женщина может получить при выборе этого метода обезболивания. Также можно упомянуть уменьшение стрессовых реакций у женщины в родах, возможность для нее расслабиться и отдохнуть и вероятная возможность сэкономить время на постановку обезболивания при необходимости выполнения экстренного кесарева сечения.
Обезболивание родов
Кокрейновский обзор 2018 года включил 40 РКИ (более 11 000 женщин), которые были посвящены сравнению эпидуральной анестезии с другими методами обезболивания или их отсутствием. Из них 34 исследования, в которые вошли 10440 женщин, сравнивали ЭА с опиоидным обезболиванием, и 7 исследований с общим числом участниц 897, сравнивали ЭА с плацебо или отсутствием обезболивания.
При сравнении главного первичного исхода, то есть уровня обезболивания родов, ЭА в сравнении с опиоидными препаратами показала среднее снижение баллов по визуальной аналоговой шкале на 2,64. При сравнении ЭА с плацебо и отсутствием медикаментов, группы женщин, получавших ЭА также сообщали о меньшей боли.
Одно исследование сравнивало ЭА и аку-стимуляцию (но в него вошло только 60 женщин): в группе ЭА также были отмечены статистически меньшие баллы по ВАШ в сравнении с стимуляцией активных точек.
Еще одно исследование сравнивало ЭА и ингаляционную анестезию (оно было также небольшим, суммарно в нем приняли участие 87 женщин): больше женщин отметили эффект обезболивания как очень хороший или отличный в группе ЭА, в сравнении с группой ингаляционных обезболивающих препаратов.
И еще одно исследование сравнивало ЭА и непрерывную поддержку (в него вошли 992 женщины): все женщины в группе ЭА и почти 99% в группе поддержки оценили уровень обезболивания как «очень хороший или отличный».
Возможность отдохнуть
В описательных исследованиях можно встретить упоминания о том, что при выполнении ЭА мамы могут отдохнуть, поспать и полежать – при хорошем уровне обезболивания им не нужно «проживать» схватки, и они могут расслабиться в комфортном состоянии. Это относится как к методам с блокадой двигательных нервов, при которых мама не может встать, так и к методам «ходячего» обезболивания (спинальная или комбинированная анестезия). Рандомизированных исследований об этом преимуществе нет по понятным причинам.
Возможность сэкономить время на постановку ЭА
ACOG в своем практическом бюллетене за 2019 год, посвященном различным видам обезболивания в родах, сообщает о том, что в случае, если женщине в родах требуется экстренное кесарево сечение, то при наличии уже действующей эпидуральной анестезии для адекватного операционного обезболивания требуется лишь болюсное введение местного анестетика с более высокой концентрацией в эпидуральный катетер. Эта процедура может быть выполнена во время подготовки к переводу в операционную. Среднее время достижения необходимого уровня обезболивания занимает около 10 минут. Если же у мамы отсутствует ЭА, то при возникновении необходимости выполнения ЭКС ей будет необходимо выполнить спинальную анестезию или общую анестезию. При этом время выполнения спинальной анестезии составляет в среднем 9 минут, а общей анестезии — всего лишь 2 минуты. Несмотря на такое противоречие (на спинальную и общую анестезию требуется меньше времени, чем на болюсное введение анестетика к ЭА), установленная ЭА все же может иметь преимущество — за счет того, что при выполнении спинальной анестезии чаще возникают сложности с установкой катетера, а при выполнении общей анестезии возможны побочные эффекты для мамы и малыша.
Снижение стрессовых реакций
В исследовании 1983 года авторы брали образцы крови во время родов у 15 пациенток. Первые образцы брали на пике схватки и после двух подряд сильных схваток. После этого мамам вводили анестетик в эпидуральное пространство и после начала его действия снова брали образцы крови. В образцах определяли уровни адреналина и норадреналина.
Затем авторы сравнивали уровни этих гормонов в образцах крови до и после обезболивания и отметили, что в образцах крови, взятых после обезболивания, уровень адреналина достоверно снизился — на 56% (р <0,01). Уровни норадреналина также снизились, но примерно на 19%, и это снижение не было статистически значимым.
Авторы пришли к выводу, что «эпидуральная анестезия во время родов снижает уровень адреналина у матери, вероятно, путем устранения психологического и физического стресса, связанного с болезненными сокращениями матки, или путем денервации мозгового вещества надпочечников. Каким бы ни был механизм, уменьшение боли и активности симпатической нервной системы должно усиливать маточный кровоток».
Риски ЭА в родах
За те годы, что эпидуральная анестезия применяется в родах, было проведено достаточно большое количество исследований, оценивающих различные риски этой процедуры для мамы и малыша. В разное время исследователи описывали следующие риски для матерей:
- Снижение артериального давления
- Повышение температуры
- Неспособность самостоятельно опорожнить мочевой пузырь
- Кожный зуд (при комбинации ЭА и опиатов)
- Озноб
- Угнетение сознания
- Тошнота и рвота
- Трудности с дыханием
В практическом бюллетене ACOG за 2019 год, посвященный анальгезии и анестезии в родах, указано следующее:
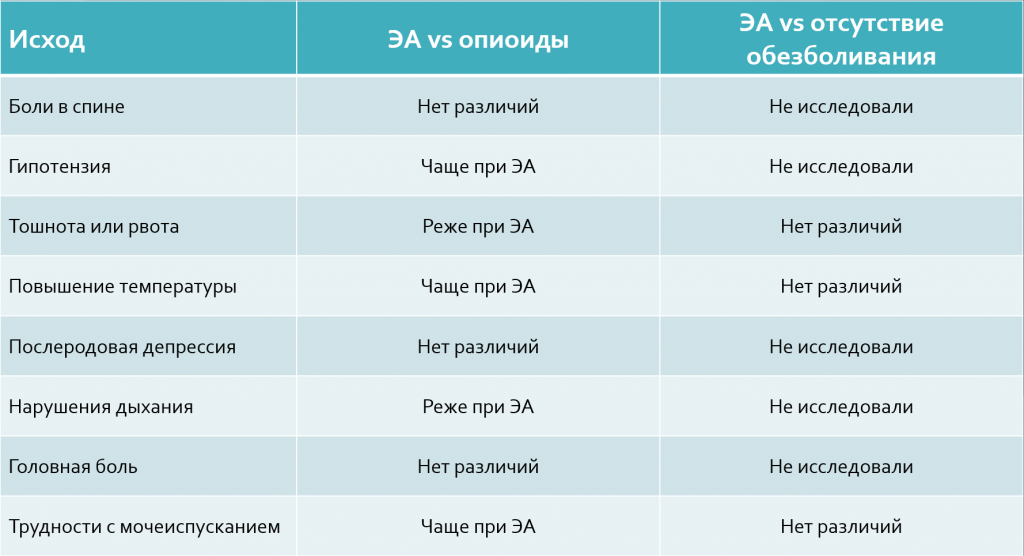
Риск головной боли после родов оказывается на уровне 0,7% от всех нейроаксиальных процедур, которые включали в себя прокол твердой мозговой оболочки (спинальная и комбинированная спинально-эпидуральная анальгезия). Другие материнские неблагоприятные эффекты, связанные с нейроакисальными методами обезболивания, включают материнскую гипотензию и зуд при применении опиатов в ЭА. Зуд возникает у подавляющего большинства женщин после родов, которые получали нейроаксиальные опиоиды. Вероятность материнской гипотензии зависит от скорости возникновения нейроаксиального блока и дозы анестетика. Примерно у 10% женщин будет развиваться гипотензия даже с низкодозной анальгезией. Эпидуральная, в отличие от спинальной анестезии, позволяет медленно титровать анестетик и, следовательно, реже вызывает гипотензию. Дополнительные неблагоприятные эффекты нейроаксиальных методов включают тошноту и рвоту (когда используются опиоиды), повышение температуры или лихорадку, дрожь, нарушения выведения мочи и реактивацию перорального герпеса. Угнетение дыхания представляет собой риск при использовании опиоидов, независимо от того, являются ли они нейроаксиальными или парентеральными.
В систематический обзор, который был опубликован в 2002 году, вошли 19 проспективных РКИ из США, Канады, Бельгии, Сингапура, Италии, Франции и Норвегии. Общее числе исследуемых женщин составило 2708, а размеры выборок в отдельных публикациях варьировались от 24 до 880 человек. В 18 исследованиях использовались опиоиды для усиления эффекта локальных анестетиков, в 7 исследованиях применяли эпинефрин для пролонгации анальгетического эффекта. Авторы рассматривали следующие побочные эффекты: зуд, тошнота и рвота, неспособность помочиться, седативный эффект, гипотензия, нарушения двигательной активности. В этом систематическом обзоре авторы приводят такие результаты:
- Зуд. Среди мам, у которых ЭА была выполнена в комбинации с опиатами, частота зуда составила от 8 до 100% (наибольшая частота отмечена в исследованиях с наиболее высокими дозами наркотических обезболивающих). В 6 исследованиях, которые рассматривали не комбинированные препараты для ЭА, частота зуда составила от 0 до 4%
- Тошнота и рвота. Среди исследований, которые оценивали встречаемость тошноты, частота этого побочного эффекта в среднем составила 7,3%. В тех исследованиях, которые оценивали тошноту и рвоту как один симптом, его частота составила в среднем 4,6%
- Гипотензия. Среди исследований, которые оценивали этот исход, частота гипотензии у мам с ЭА варьировалась от 0 до 50%. При этом в бюллетене ACOG за 2019 указаны последние данные – около 10% мам испытают падение давления при низкодозной нейроаксиальной анестезии. Снижение давления при постановке эпидуральной анестезии может вызывать изменения в сердечном ритме плода. Этот эффект может длиться около 20 минут, и в большинстве случаев изменения ритма проходят спонтанно, например при изменении положения тела женщины, и лишь в редких случаях требуют введения медикаментов. В случае более серьезных нарушений ритма и развивающегося впоследствии дистресс-синдрома может потребоваться проведение оперативного родоразрешения
- Седативный эффект. Средняя частота проявления седативного эффекта составила 21% (диапазон от 1 до 56%). Самая высокая частота этого побочного эффекта наблюдалась в группах женщин, получавших дозы суфентанила от 5 до 10 мкг
- Затруднение мочеиспускания. В качестве измеримого исхода авторы выбрали такую неспособность помочиться, которая требовала катетеризации для выведения мочи. В трех исследованиях частота этого исхода варьировалась от 0 до 35%
Озноб
В обзоре 2008 года, который анализировал 21 исследование о связи ЭА и озноба (данные собирали за период с 1950 по 2007 год) авторы сообщают о частоте этого побочного эффекта в среднем в 55% случаев. ЭА приводит к нарушению вегетативной терморегуляции ниже уровня блока — происходит перераспределение тепла от корпуса к периферическим тканям. И за счет вазодилатации ниже уровня блока происходят потери тепла (по данным разных авторов, эти потери составляют снижение температуры на 0,8±0,3 градуса в первый час и еще на 0,4±0,2 в последующие 2 часа). При спинальной анестезии температура снижается быстрее в первые 30 минут, чем при ЭА. Потери тепла приводят к физиологическому ознобу. Хотя озноб может иметь полезные терморегуляторные эффекты, он ставит организм в состояние физиологического стресса, который может быть вредным. Озноб может удвоить потребление кислорода и выделение углекислого газа, хотя увеличение последнего обычно значительно меньше. Катехоламины плазмы и сердечный выброс увеличиваются в ответ на этот физиологический стресс. Озноб при ЭА может мешать мониторингу артериального давления, электрокардиограмме и пульсовой оксиметрии, а также снижать комфорт и удовлетворенность пациента.
Риск послеродового кровотечения
Ранние исследования (начало и середина 90-х годов) сообщают о возможной связи ЭА и более выраженного послеродового кровотечения, хотя современные публикации и руководства акушерских организаций не сообщают об этом побочном эффекте. Это может быть связано как с модернизацией техники нейроаксиального обезболивания и использованием других режимов анестезии, так и с изменением подхода к ведению третьего периода родов с преимущественно активной позиции и введением окситоцина для профилактики послеродового кровотечения.
Выше упомянутый Кокрейновский обзор 2018 года оценивал различные побочные эффекты для матери в разных группах сравнения:
Риски для малыша
Уже упомянутый выше Кокрейновский обзор при сравнении ЭА с опиоидными анальгетиками (34 исследования, более 10000 женщин) показал меньшее количество детей с ацидозом (уровень pH артериальной пуповинной крови менее 7,2) у матерей, получавших ЭА. Им также реже требовался налоксон. Различий в частоте низких баллов по шкале Апгар (менее 7 на 5 минуте) между этими группами не было. Долгосрочные последствия для детей и частота родовых травм не оценивались в исследованиях, которые вошли в эту группу сравнения.
В этот систематический обзор вошли 7 исследований (897 женщин), в которых помимо групп женщин, получавших ЭА, присутствовали группы, получавшие плацебо или не получавшие обезболивание. Выборки этих исследований были небольшими, по 30-40 человек для отдельных групп сравнения. Два исследования, рассматривавших баллы по шкале Апгар в качестве исходов для новорожденных, не обнаружили различий между группами ЭА и контрольными группами без обезболивания. Остальные исходы для детей в этих исследованиях не рассматривались. Важно понимать, что это были очень небольшие исследования, хотя по дизайну они и были рандомизированными.
Влияние на роды
Кокрейновский обзор при сравнении ЭА с опиоидами показал, что инструментальные вагинальные роды чаще происходят при ЭА, но при анализе только тех исследований, которые были выполнены после 2005 года, различий не оказалось.
При сравнении ЭА с отсутствием обезболивания в родах обзор показал, что кесарево сечение реже встречалось в группе ЭА. Такой результат противоречит ранее полученным данным и, хотя и получен при проведении РКИ, все же может не отражать реальных взаимовлияний манипуляций в родах. Исследования, вошедшие в Кокрейновский обзор 2018 года, и сравнивающие ЭА с отсутствием обезболивания, имели очень небольшие группы сравнения (по 30 человек) и в них не были указаны показания к КС. Поэтому остается открытым вопрос, можно ли использовать эти данные для всех женщин.
Когда в нашем распоряжении нет крупных рандомизированных исследований, можно обратить внимание на обсервационные или популяционные исследования с большими выборками. Именно такое было опубликовано в 2014 году австралийскими авторами. Это обсервационное популяционное исследование рассматривало роды у 170+ тысяч женщин, которые прошли в 2007-2010 гг., а также особенности течения этих родов и акушерские осложнения у мам, которые рожали одного ребенка. Это были роды низкого риска: КС до начала родов, КС в анамнезе или КС по неклиническим показаниям были исключены. Все КС в исследовании были проведены после начала родов у женщин без рубца на матке, в связи либо со слабостью родовой деятельности, либо с дистресс-синдромом. Также были исключены: предлежание плаценты и ее отслойка, дети малого для гестационного возраста веса, дети в не головном предлежании. Женщины с индукцией простагландинами или окситоцином были включены только случае, если показанием был разрыв плодных оболочек до начала родов или переношенная беременность, поскольку эти условия не связаны с повышенным риском КС. Были исключены все случаи индукции родов в связи с заболеваниями ребенка, сопутствующими заболеваниями матери или признаками нарушения роста плода, поскольку ведение родов в этих случаях отличается ведения родов низкого риска.
Авторы получили следующие результаты:
Среди всех женщин Нового Южного Уэльса, которые приняли участие в исследовании, 9,2% родили при помощи КС: 6,1% по причине СРД и 3,1% из-за состояния плода. Эпидуральная анестезия была применена у 31,6% женщин, из которых 20,5% имели кесаревы роды. Авторы провели сопоставление групп по возрасту, паритету и другим параметрам, и после сопоставления получили увеличение частоты КС в 2,63 раза для тех женщин, у которых была применена ЭА: 18,6% в группе ЭА в сравнении с 7,08% в группе без обезболивания.
Послесловие
Современные исследования, посвященные ЭА, очень разнообразны и весьма противоречивы. На данный момент мы не располагаем доказательствами высокой силы о связи ЭА и повышенного риска каких-либо исходов для мамы и малыша. Есть исследования, которые говорят об увеличении первого и второго периода родов при ЭА, влиянии на частоту инструментальных родов. В отношении связи ЭА и КС многие авторы призывают смотреть не только на факт наличия или отсутствия ЭА, но и на другие параметры: паритет родов, фоновый процент кесаревых сечений в том месте, где выполнено исследование, размер этой больницы, акушерский статус беременных, которые принимали участие в исследовании и др.
[pdf-embedder url=»https://doula.link/wp-content/uploads/2020/05/Epidural.pdf»]